药用玻璃行业隶属于医药包装材料行业,政府主管部门为国家药品监督管理局,其主要职责为:制定药品及药包材监督管理的政策、规划并监督实施,参与起草有关规定法律法规和部门规章草案;拟定国家药品及药包材的标准、分类管理制度;负责对药品及药包材的研究、生产、流通、使用进行行政监督和技术监督。
中国医药包装协会是医药包装行业的自律性组织,其主要职责为:宣传和贯彻国家相关的方针、政策和法规,做好医药包装行业质量监督和行业规范工作; 制定医药包装行业发展规划,促进行业发展;组织调查研究医药包装材料、容器、机械及相关药用辅料市场动态,及时传递市场信息;组织并且开展医药包装技术的合作、研究,推广有关医药包装新技术、新材料、新工艺、新设备和咨询服务工作;宣传贯彻国家标准,参与制修订行业标准,组织制定发布行业自愿执行的协会标准。
目前,我国药包材行业监督管理体制为关联审评审批制度,未依规定审评审批的包装材料禁止用来生产药品。我国药包材行业的监管经历了由注册审批管理制度到关联审评制度的转变。
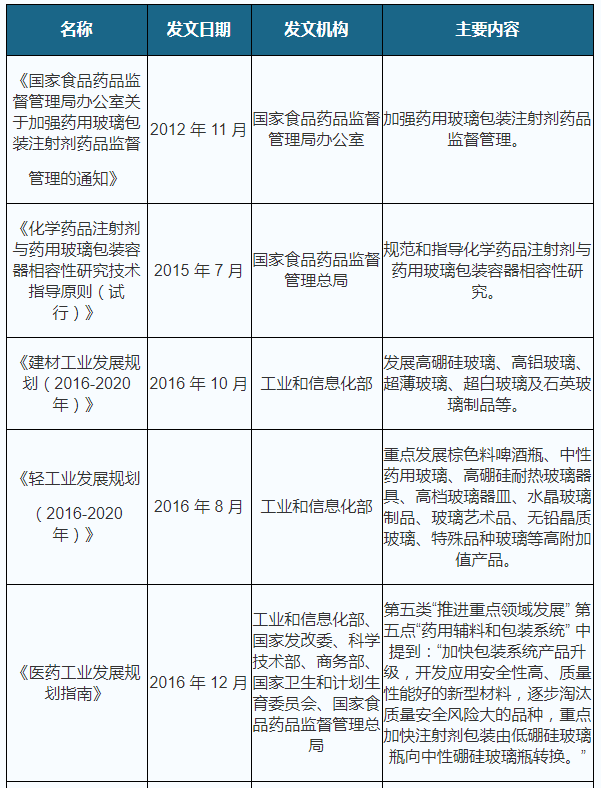
2004 年,国家食药监局发布第 13 号令《非间接接触药品的包装材料和容器管理办法》,凡在中国大陆生产和使用的药包材,必须申请注册,经国家食药监局批准后方可生产、进口和使用。产品按国家公布的注册品种目录实施分类注册,我国对药包材实施产品注册审批管理制度。
2015 年 8 月 18 日,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发[2015]44 号),对药品审批程序提出简化要求,完善药品监督管理体系;实行药品与药用包装材料、药用辅料关联审批,将药用包装材料、药用辅料单独审批改为在审批药品注册申请时一并审评审批。2016 年 8 月 10 日,国家食药监局发布《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》(2016 年第 134 号),根据该文,药包材由单独审批改为在审批药品注册申请时一并审评审批。对于目前已取得批准文号的药包材注册证,其在效期内继续有效。有效期届满后,仍可继续在原药品中使用。药包材监督管理体制进入药包材注册审批与关联审评审批并存的阶段。
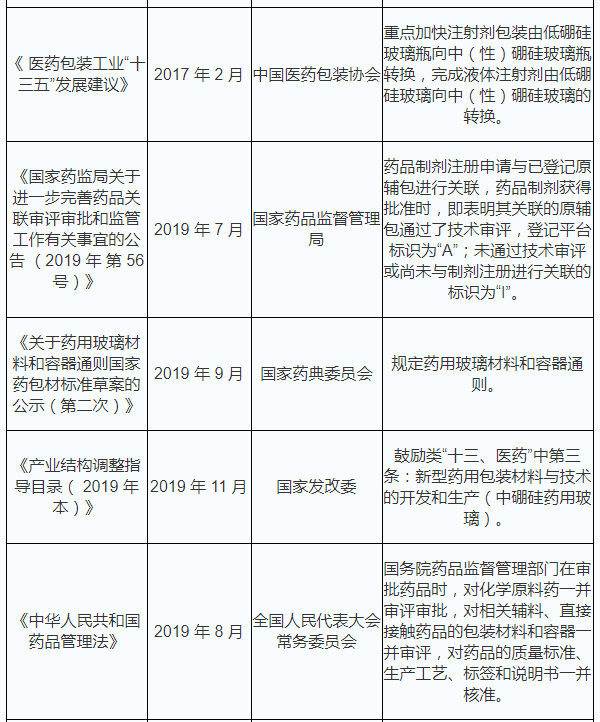
2019 年 7 月 16 日,国家药监局发布了《国家药监局关于加强完善药品关联审评审批和监管工作有关事宜的公告》(2019 年第 56 号),精确指出,药品制剂注册申请与已登记原辅包进行关联,药品制剂获得批准时,即表明其关联的原辅包通过了技术审评,登记平台标识为“A”;未通过技术审评或尚未与制剂注册进行关联的标识为“I”。批准证明文件有效期届满日不早于 2016 年 8 月 10 日的药包材,由药审中心将有关信息转入登记平台并给予登记号,登记状态标识为“A”。药包材监督管理体制正式步入关联审评审批制度。
2019 年 12 月 1 日,最新修订的《中华人民共和国药品管理法》开始实施, 进一步明确规定:国务院药监管理部门在审批药品时,对化学原料药一并审评审批,对相关辅料、非间接接触药品的包装材料和容器一并审评,对药品的品质衡量准则、生产的基本工艺、标签和说明书一并核准。
玻璃制品行业是国家长期重点支持发展的产业。近年来,国家有关部门出台了一系列政策来支持药用玻璃产业的发展,具体明细如下:
《2021年中国药用玻璃市场分析报告-行业规模与发展的潜在能力预测》返回搜狐,查看更加多
